Un biosimilare è sviluppato per essere altamente simile ad un altro medicinale biologico già approvato ed utilizzato nell'UE (Unione Europea), definito medicinale di riferimento.1
Per comprendere i biosimilari, è importante prima sapere cosa sia un biologico.
I medicinali biologici contengono sostanze attive ottenute a partire da una fonte biologica, come cellule viventi o organismi, la maggior parte delle quali è rappresentata da proteine.2 Queste possono differire per dimensione e complessità strutturale, da proteine semplici come l'insulina o l'ormone della crescita a proteine più complesse come i fattori della coagulazione o gli anticorpi monoclonali.3
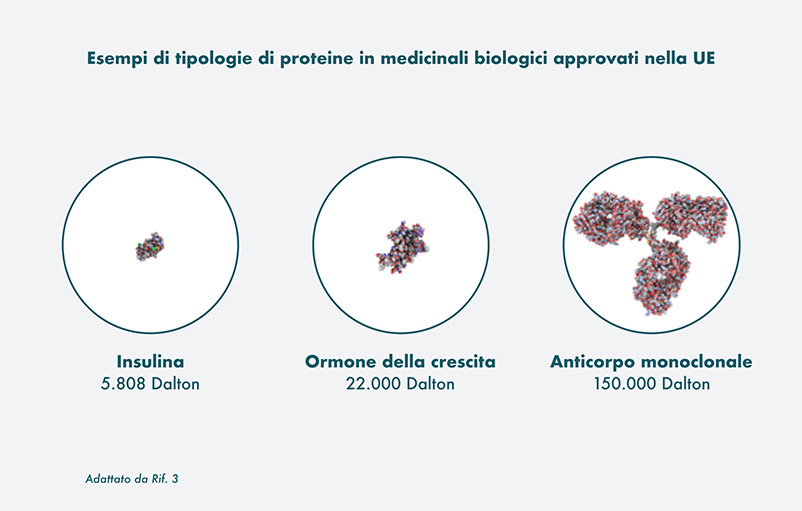
Queste sostanze attive sono solitamente di dimensioni maggiori e strutturalmente complesse rispetto a quelle dei medicinali non biologici.1
I farmaci biologici e i loro biosimilari sono utilizzati per trattare molte malattie. Queste includono:
Nonostante i medicinali biologici siano un valido aiuto per i pazienti affetti da malattie gravi, la loro complessità, i costi elevati e i lunghi tempi di sviluppo ne limitano talvolta l'accesso ai pazienti e possono rappresentare un onere per la sostenibilità del sistema sanitario.3

Un biosimilare non presenta differenze clinicamente significative in termini di sicurezza, qualità ed efficacia rispetto al suo medicinale di riferimento. È, infatti, altamente simile al biologico di riferimento già approvato nell'UE in termini di struttura, attività biologica ed efficacia, profilo di sicurezza e immunogenicità (ovvero, la capacità intrinseca delle proteine e di altri medicinali biologici di provocare una risposta immunitaria).3
Altamente simile significa che il biosimilare e il suo medicinale di riferimento sono essenzialmente uguali, anche se possono esserci lievi differenze nelle loro sostanze attive. Un certo grado di variabilità è intrinseco a tutti i medicinali biologici e possono verificarsi lievi differenze tra diversi lotti dello stesso medicinale biologico. Tali modifiche sono rigorosamente regolamentate dall'Agenzia Europea per i Medicinali (EMA). Eventuali differenze tra il biosimilare e il suo medicinale di riferimento sono mantenute entro limiti rigorosi per garantire che entrambi siano efficaci e sicuri allo stesso modo.3
Un biosimilare e il suo medicinale di riferimento sono entrambi:
Questo elevato livello di somiglianza assicura affidabilità nel passaggio da un biologico a un biosimilare.4
Il biosimilare e il rispettivo medicinale di riferimento possono essere paragonati a foglie di uno stesso albero: appaiono uguali e svolgono la stessa funzione, ma al microscopio si possono osservare lievissime differenze, dovute al fatto che si fondano su processi biologici.3
Un generico è un farmaco non biologico che contiene esattamente la stessa molecola del suo medicinale di riferimento.9 Può essere riprodotto direttamente perché è rappresentato generalmente da molecole di piccole dimensioni e meno complesse strutturalmente.10 Tuttavia, gli eccipienti, il nome, l'aspetto e il confezionamento possono differire rispetto al medicinale di riferimento.11
I biosimilari non sono generici perché non possono essere copiati esattamente.1
I biosimilari e i generici differiscono in modo significativo per quanto riguarda la composizione, lo sviluppo e gli iter regolatori.12
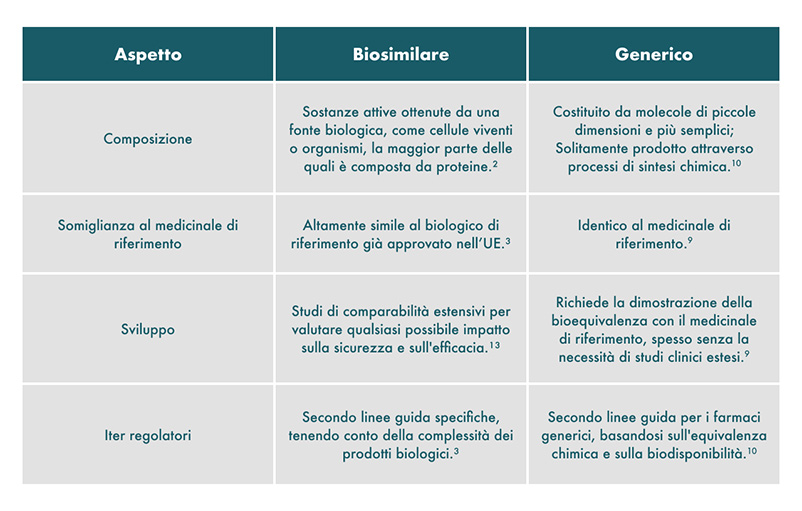
I medicinali biologici sono costituiti da molecole strutturalmente complesse e il loro sviluppo richiede processi lunghi e molto costosi.1
I biosimilari sono sviluppati con l'obiettivo di offrire benefici terapeutici comparabili a costi potenzialmente inferiori, migliorando l'accesso dei pazienti a trattamenti essenziali.3

Infatti:
Nel complesso, quindi, i biosimilari offrono ai sistemi sanitari e ai pazienti l'accesso a trattamenti innovativi a un costo più sostenibile.14

I biosimilari sono sottoposti a un processo di valutazione estremamente rigoroso prima di essere approvati per l'uso clinico.3 Le autorità regolatorie, come l'Agenzia Europea per i Medicinali (EMA) in Europa e la Food and Drug Administration (FDA) negli Stati Uniti, esaminano attentamente studi, dati e test per garantire che ogni biosimilare soddisfi gli standard richiesti nel paese in cui sarà commercializzato.8
Poiché un biosimilare è altamente simile al suo medicinale di riferimento, può spesso fare affidamento sui dati già disponibili relativi alla sicurezza e all'efficacia di quest'ultimo. Questo approccio, noto come estrapolazione, consente di ridurre il numero di studi clinici necessari, accelerando così l'accesso dei pazienti a nuovi trattamenti.3
Le autorità regolatorie valutano caso per caso se siano necessari ulteriori studi. L'obiettivo principale non è ripetere l'intero percorso clinico, ma dimostrare che non esistono differenze clinicamente significative tra il biosimilare e il medicinale originario. Questo processo prende il nome di dimostrazione della biosimilarità.1
Un biosimilare può essere approvato, infatti, solo dopo la dimostrazione della biosimilarità, ovvero dopo aver ottenuto risultati sovrapponibili al medicinale di riferimento nelle seguenti aree:1,4
Per garantire questi requisiti, si eseguono test di comparabilità articolati in tre fasi:13
Anche dopo l'approvazione, i biosimilari sono sottoposti a un monitoraggio continuo per garantire che mantengano nel tempo gli stessi standard di qualità, sicurezza ed efficacia. Questo sistema di sorveglianza post-marketing è identico a quello previsto per tutti i medicinali biologici. In Europa, l'EMA effettua inoltre ispezioni regolari presso i siti di produzione per assicurarsi che gli standard di qualità siano rispettati.13
RIFERIMENTI
1. European Commission. Biosimilar Medicines [PDF]. 2016.
2. Cordeiro MA, et al. Pharmaceutics. 2024;16(3):321.
3. European Medicines Agency. Biosimilars medicines: Overview. Disponibile al sito: https://www.ema.europa.eu/en/human-regulatory-overview/biosimilar-medicines-overview. Ultimo accesso: Luglio 2025.
4. NHS England. What is a biosimilar medicine? Disponibile al sito: https://www.england.nhs.uk/long-read/what-is-a-biosimilar-medicine/. Ultimo accesso: Luglio 2025.
5. Crohns and Colitis UK. Biologics and other targeted medicines. Disponibile al sito: https://crohnsandcolitis.org.uk/info-support/information-about-crohns-and-colitis/all-information-about-crohns-and-colitis/treatments/biologics-and-other-targeted-medicines. Ultimo accesso: Luglio 2025.
6. Macular Society. Treatments. Disponibile al sito: https://www.macularsociety.org/diagnosis-treatment/treatments. Ultimo accesso: Luglio 2025.
7. ABPI. Intellectual property: enabling next-generation innovation. Disponibile al sito: https://www.abpi.org.uk/international-trade-and-ip/intellectual-property-ip/intellectual-property-enabling-next-generation-innovation/. Ultimo accesso: Luglio 2025.
8. US Food and Drug Administration. Biosimilar and Interchangeable Biologics: More Treatment Choices. Disponibile al sito: https://www.fda.gov/consumers/consumer-updates/biosimilar-and-interchangeable-biologics-more-treatment-choices. Ultimo accesso: Luglio 2025.
9. US Food and Drug Administration. Generic Drugs: Questions & Answers. Disponibile al sito: https://www.fda.gov/drugs/frequently-asked-questions-popular-topics/generic-drugs-questions-answers. Ultimo accesso: Luglio 2025.
10. Heinrichs MJ, Owens GM. Where generics and biologics meet. Am Health Drug Benefits. 2008;1(5):21-6.
11. EMA Generic and hybrid medicines. Disponibile al sito: https://www.ema.europa.eu/en/human-regulatory-overview/marketing-authorisation/generic-hybrid-medicines. Ultimo accesso: Luglio 2025.
12. EMA Biosimilar medicines: marketing authorisation. Disponibile al sito: https://www.ema.europa.eu/en/human-regulatory-overview/marketing-authorisation/biosimilar-medicines-marketing-authorisation. Ultimo accesso: Luglio 2025.
13. Biosimilars in the EU: Information Guide for Healthcare Professionals. Prepared jointly by the European Medicines Agency and the European Commission. Disponibile al sito: https://www.ema.europa.eu/en/documents/leaflet/biosimilars-eu-information-guide-healthcare-professionals_en.pdf. Ultimo accesso: Luglio 2025.
14. World Health Organization. Biosimilars: expanding access to essential biologic therapies. Disponibile al sito: https://www.who.int/news/item/13-02-2025-biosimilars--expanding-access-to-essentialbiologic-therapies. Ultimo accesso: Luglio 2025.
15. IQVIA. The Impact of Biosimilar Competition in Europe 2024. Disponibile al sito: https://www.iqvia.com/library/white-papers/the-impact-of-biosimilar-competition-in-europe-2024. Ultimo accesso: Luglio 2025
IT/MISC/NP/0005