L'ipogonadismo maschile è a una sindrome clinica che si verifica quando i testicoli non riescono a produrre livelli fisiologici di testosterone, livelli normali di sperma o entrambi.1

L'ipogonadismo primario è causato dall'insufficienza testicolare ed è associato a disfunzione testicolare, bassi livelli sierici di testosterone, compromissione della spermatogenesi, aumento del livello di gonadotropine, aumento del livello dell'ormone luteinizzante ed aumento del livello dell'ormone follicolo-stimolante.2
Nell'ipogonadismo secondario, i difetti nell'ipotalamo o nell'ipofisi determinano bassi livelli di testosterone a causa dell'insufficiente stimolazione delle cellule di Leygig.
L'ipogonadismo secondario è associato a disturbi dell'ipotalamo e dell'ipofisi, bassi livelli sierici di testosterone, diminuzione della spermatogenesi, livelli bassi o non normali dell'ormone luteinizzante e dell'ormone follicolo-stimolante.2
Insieme l'insufficienza testicolare primaria e secondaria determinano bassi livelli di testosterone e livelli variabili di gonadotropine, questa forma è anche conosciuta come ipogonadismo ad esordio tardivo e ipogonadismo legato all'età.3
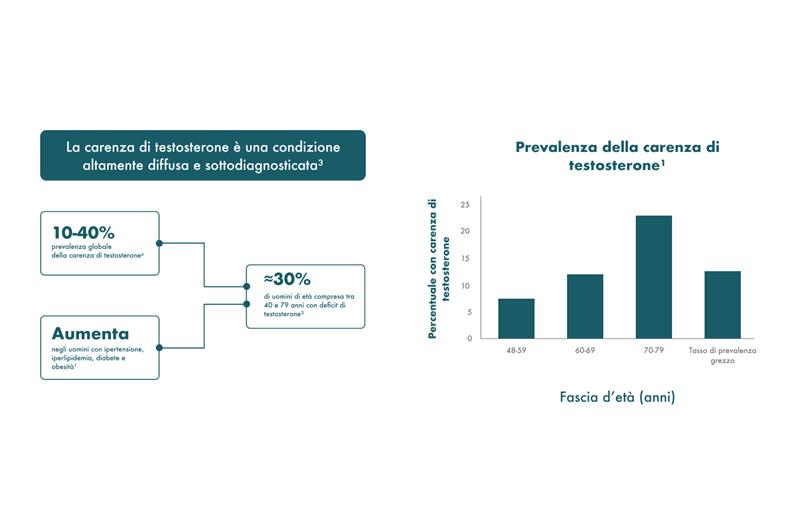
La prevalenza dell'ipogonadismo aumenta significativamente con l'età.4
Poiché l'invecchiamento negli uomini è associato ad un aumento del rischio di comorbidità che contribuiscono alla riduzione del testosterone, l'ipogonadismo diventa sempre più diffuso negli uomini di età superiore ai 40-50 anni.5
L'ipogonadismo è comune negli uomini con diabete di tipo 2 (T2DM), definito da livelli di testosterone sierico < 12nmol/L e sintomi sessuali.13
Bassi livelli di testosterone e di globulina legante gli ormoni sessuali (SHBG) predicono l'insorgenza tardiva del diabete mellito di tipo 2 (T2DM) e della sindrome metabolica, indipendentemente dall'obesità e dalle comorbilità. La relazione tra bassi livelli di testosterone e malattia cronica, sindrome metabolica e T2DM è bidirezionale.15
Tuttavia, livelli sierici di testosterone più alti del normale rappresentano anche un indicatore prognostico sfavorevole negli uomini con T2DM.16
L'ipogonadismo è associato a obesità centrale, iperglicemia, resistenza all'insulina e dislipidemia (basso colesterolo HDL, aumento del colesterolo totale e LDL e dei trigliceridi), ipertensione e predisposizione al T2DM, che sono tutti componenti della sindrome metabolica.17
L'obesità compromette i livelli di testosterone mentre bassi livelli di testosterone promuovono un aumento della deposizione di grasso, questo circolo vizioso è stato inizialmente proposto come ciclo ipogonadico-obesità:18,19
Esistono molti dati che dimostrano come l'ipogonadismo sia associato ad un aumento degli eventi cardiovascolari (CVE).20
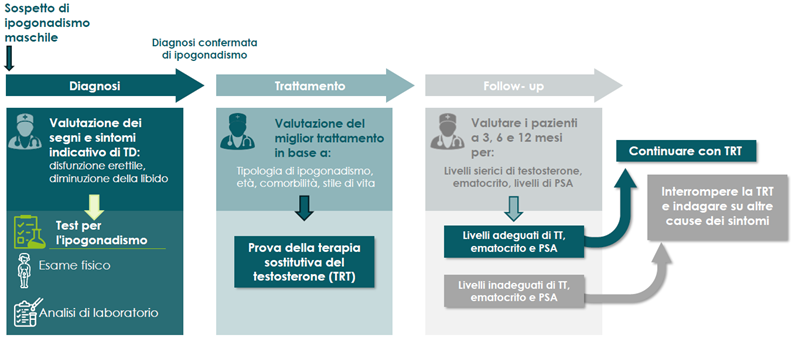
Per determinare se un paziente ha una carenza di testosterone, il medico deve considerare i segni e i sintomi clinici insieme ai valori dei test di laboratorio.
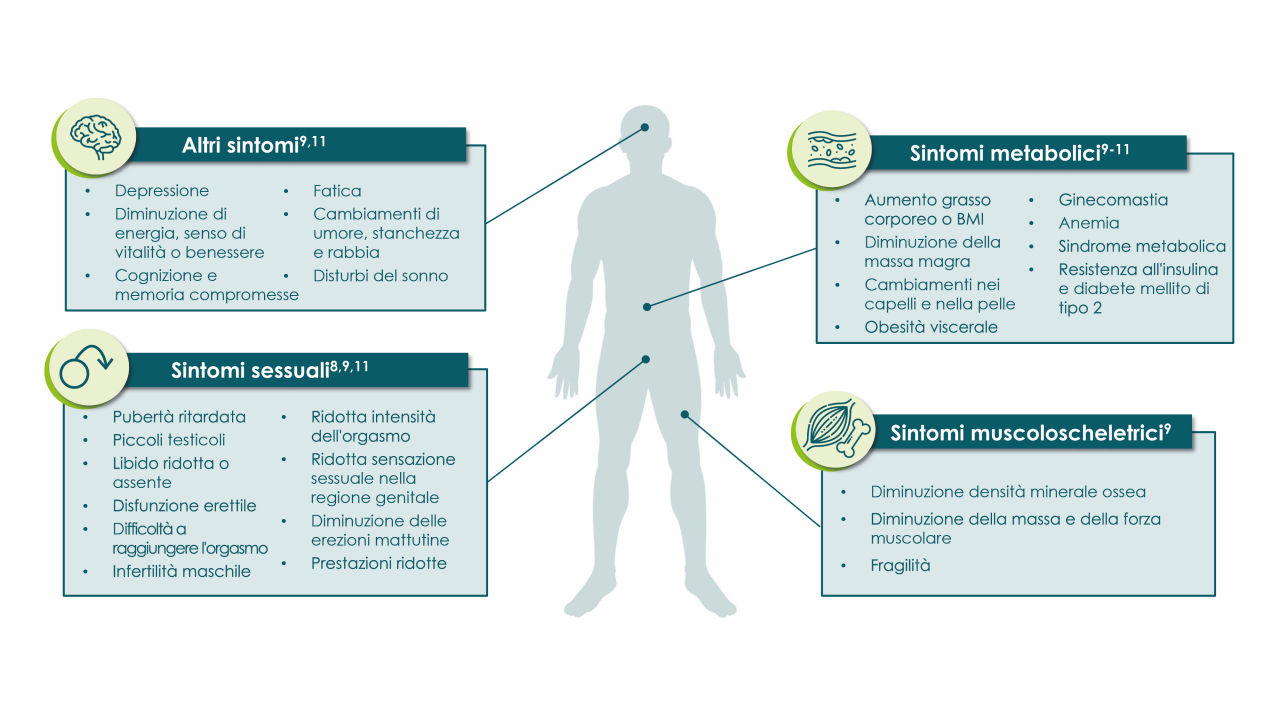
Segni e sintomi della carenza di testosterone (TD) variano notevolmente a seconda dell'età di insorgenza dell'insufficienza testicolare e della sua estensione.

Sintomi clinici
Testicoli sottosviluppati, mancanza di ingrossamento del pene e assenza di peli pubici, ausiliari e facciali.
Valori di laboratorio
Sintomi clinici
Perdita della libido, disfunzione erettile, diminuzione della capacità intellettuale, depressione, letargia, osteoporosi, perdita di massa e forza muscolare e una certa regressione delle caratteristiche sessuali secondarie.
Sintomi clinici
Bassa libido, impotenza, affaticamento, difficoltà di concentrazione e disfunzione sessuale.
Cambiamenti della funzione intellettuale e dell'umore.
Presenza di ginecomastia o carcinoma del seno sono importanti riscontri fisici.
1. Gould, DC. The Journal of Men's Health & Gender. 2007;4:419-27;
2. Dandona, P et al. Int J Clin Pract. 2010;64:682-96;
3. Dohle, G et al. (2015), (European Association of Urology
4. Gould, DC. The Journal of Men's Health & Gender. 2007;4:419-27
5. Yeo, S et al. Clinicoecon Outcomes Res. 2021;13:31-38;
6. Traish, AM et al. Am J Med. 2011;124:578-87
7. Anaissie et al. Transl Androl Urol. 2017;6:183-91
8. Morgentaler et al. Sex Med Rev. 2019;7:636-49
9. Traish et al. Am J Med. 2011;124:578-87
10. Carnegie. Rev Urol. 2004;6 Suppl 6:S3-8;
11. Dohle, G et al. (2015), (European Association of Urology).
12. Yeo, S et al. Clinicoecon Outcomes Res. 2021;13:31-38
13. Hackett, G. Ther Adv Urol. 2016;8:147-60;
14. Hackett, G et al. Andrology. 2017;5:905-13;
15. Hamilton, EJ et al. Clin Endocrinol (Oxf). 2016;85:444-52;
16. Li, SY et al. Int J Endocrinol. 2020;2020:4732021
17. Salonia, A et al. (2023), (EAU);
18. Kelly, DM et al. J Endocrinol. 2013;217:R25-45;
19. Cohen, PG. Med Hypotheses. 1999;52:49-51
20. Albert, SG et al. Clin Endocrinol (Oxf). 2016;85:436-43;
21. Tambo, A et al. Open Cardiovasc Med J. 2016;10:1-10; 3.
22. Carnegie, C. Rev Urol. 2004;6 Suppl 6:S3-8;
23. Buvat, J et al. J Sex Med. 2013;10:245-84
IT/TES/NP/0001 - 26/05/2025